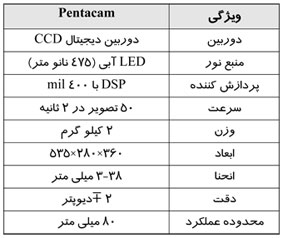
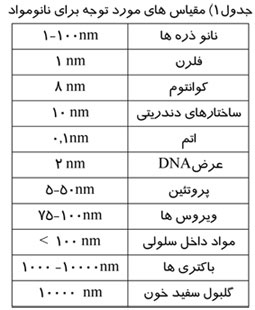
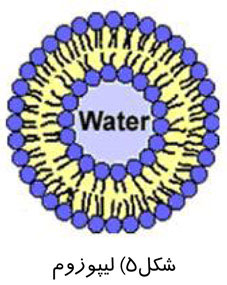
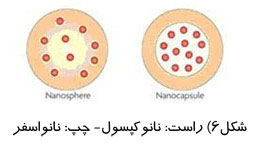
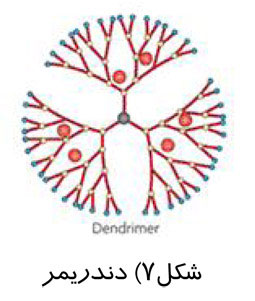
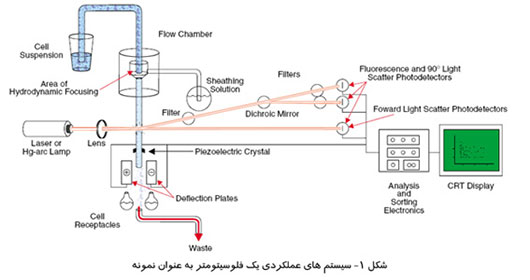
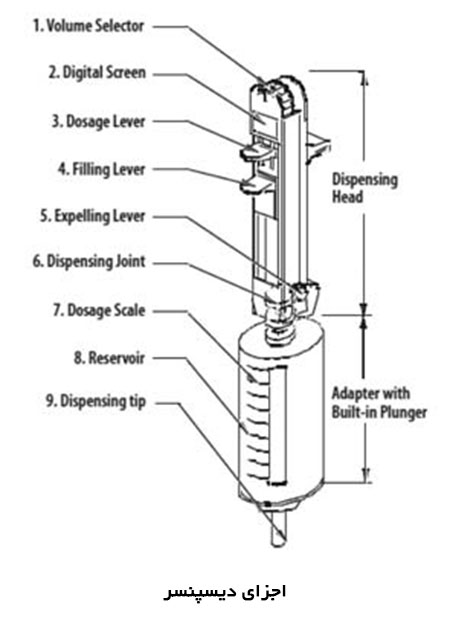
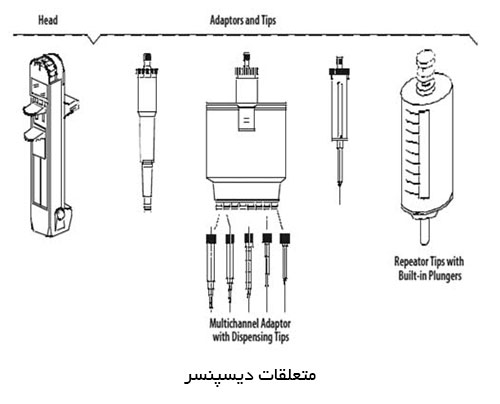
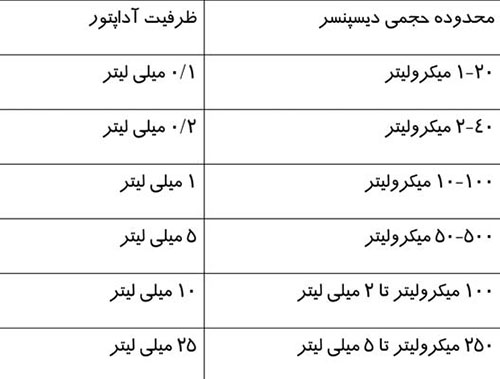
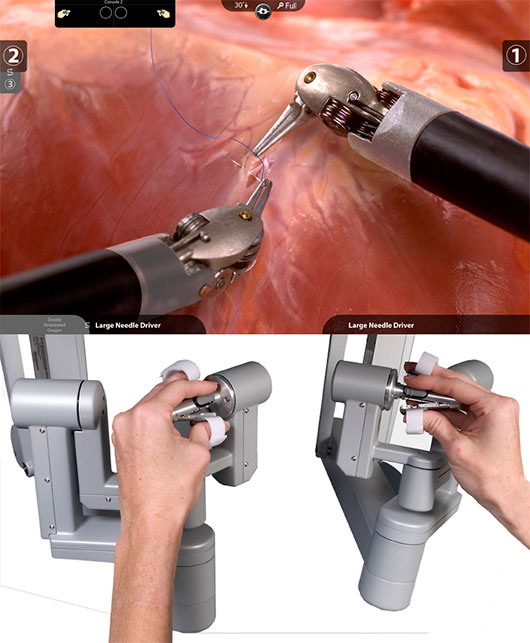
ماموگرافی را میتوان براساس هدف مورد نظر ، به دو دسته اصلی تقسيم كرد: ماموگرافی برای بيماريابی و ماموگرافی تشخيصی.
ماموگرافی برای بيماريابی
در مـقــايـســه بــا مـعــايـنــه بـالينـی ، مـامـوگـرافـی مـيتـوانـد تـعداد بسيار بيشتری از سرطانهای مهاجم پستان را كه در مراحل اوليه قرار داشته و كوچک و غيرقابل لمس هستند ، تشخيص دهد. هـمـچـنـيـن سـرطانهايی كه از نظر ابتلای غدد لنفاوی زير بغل در مراحل مقدماتی قرار دارند نيز با اين روش ، سريع تر قابل تشخيص هستند.
ماموگرافی تشخيصی
در حـال حـاضـر ، عـمـل جـراحی برای تعداد زيادی از سرطانهای پستان كه در مراحل اوليه (مــرحـلــه يــک و دو) قــرار دارنــد ، بــه صــورت محافظهكارانه صورت میگيرد. به همين دليل ، ماموگرافی اهميت بيشتری يافته است ، چرا كه به وسيله آن میتوان قبل از عمل جراحی متوجه شد كه آيا كانونهای ديگری از بافت سرطانی در پستان مبتلا وجود دارد يا خير. همچنين درباره وجود يا عدم وجود ضايعه در پستان مقابل نيز اطلاعاتی به دست میآيد.
عوامل مؤثر بر كيفيت تصوير
1- ساختمان لامپ مولد اشعه ايكس
2- اندازه نقطه كانونی يا قسمتی از هدف كه الـكـترونها روی آن متمركز میشوند. هر چه نـقـطـه كـانـونـی بزرگتر باشد، از وضوح تصوير كاسته شده و تصوير، محوتر ميشود.
3- فـاصـلـه نـقطه كانونی از عضو مورد نظر. هرچه فاصله كانونی از فيلم بيشتر باشد ، به علت واگرايی اشعه ، بزرگنمايی بيشتر خواهد بود.
از عــوامــل مـهــم ديـگــر مــیتــوان بــه جـنـس ، محتويات عضو مورد بررسی و همچنين مقدار اشعه اشاره كرد.
پيشرفتهای تكنيكی كه در سالهای اخير حاصل شده است ، بيشتر به سيستم صفحه - فيلم مــربــوط مــیشــود. صـفـحــه ، پـردهای اسـت كـه تشديد كننده اشعه بوده و همراه با فيلم امولسيون دوبل به كار می رود. اين تكنيک در مقايسه با روش صنعتی بدون صفحه ، دارای فوايد زير است:
1- بهبود كنتراست و وضوح
2- كاهش زمان قرارگيری در معرض اشعه
3- كاهش مقدار اشعه
4- ظهور خودكار
عامل مهم ديگر مؤثر بر بهبود كيفيت تصوير ، وارد آمدن فشار است. با وارد آمدن فشار روی پستـان ، فاصله فيلم از آن كاسته شده و ضخامت آن در تمامی نواحی ، يكسان میشود. همچنين حجم كل پستان به 50 تا 60 درصد حالت طبيعی كاهش میيابد. بنابراين مقدار مورد نياز اشعه كمتر شده و ميزان جذب آن نيز يكنواخت میشود. با اين روش ، مقدار پراكندگی اشعه و اشعه ثانويه داخل بافت پستان كاهش میيابد. براساس نتـايـج آخـريـن تحقيقـات ، بـرای مـامـوگـرافـی صنعتـی يـک تـا چهـار راد ، بـرای تكنيک صفحـه - فيلـم 0/04 تـا 0/08 راد و بـرای زيـرومـاموگرافی 0/3 تا 0/5 راد ، اشعه مصرف میشود.
ماموگرافی همراه با بزرگ نمايی كانونهای كوچک
برای اين بزرگ نمايی ، بايد پارامترهای زير را به طور صحيح و مرتبط با يكديگر انتخاب كرد:
1- اندازه نقطه كانونی مورد بررسی
2- ميزان قدرت تمايز ميان دو نقطه مجاور
3- مقدار هوای موجود ميان فيلم و عضو مورد بررسی
4- كيفيت اشعه ايكس
5- اندازه هدف
اين تكنيک علاوه بر اين كه كيفيت تصوير را از جنبههای گوناگون بهبود میبخشد ، تصوير محل ضايعه را نيز بزرگ تر میكند.
مزايای اين روش ، شامل موارد زير هستند:
1- وضوح تصوير
2- نويز: با وجود بزرگ شدن تصوير ، مقدار نويز آن تغيير نمی كند. بنابراين نسبت به تصوير اوليه ، نويز برابر با توان دوم بزرگ نمايی كاهش میيابد.
3- مقدار هوا: هرگاه فاصله ميان عضو و فيلم ، بيش از 15 سانتی متر باشد ، ميزان اشعه پخش شده كاهش يافته و كنتراست فيلم افزايش میيابد.
4- درک تصوير: اين روش ضمن ساده تر كردن تشخيص ميكروكلسيفيكاسيونها روی راديوگرام ، افتراق ضايعات خوش خيم و بدخيم را آسان تر كرده و نياز به انجام بيوپسی را كاهش میدهد.
در كل ، كيفيت تصوير در اين تكنيک ، به مراتب بهتر از ماموگرافی استاندارد است و اطلاعات بيشتری در اختيار پزشک و پاتولوژيست قرار میدهد اما ميزان تابش اشعه در آن سه تا چهار برابر ماموگرافی عادی است. يک سيستم برای طبقه بندی پيشرفت بيماری TNM است كه بر اساس تومور ، غدههای لنفاوی و متاستاز استوار است. اندازه و وسعت تومور در تعيين مرحله پيشرفت بيماری مؤثر است. در اين نوع رده بندی مرحله صفر تا چهار بر اساس اندازه تومور ، درگيری غده های لنفاوی و متاستاز تعريف شده است.
T شاخص اندازه تومور است.
TX: يعنی توموری در پستان قابل رديابی نيست.
T0: توموری در پستان مشاهده نمی شود.
Tis: سرطان ممكن است LCIS ، DCIS يا بيماری Paget باشد.
T1: قطر تومور دو سانتی متر يا كمتر است.
T2: قطر تومور بين دو تا پنج سانتی متر است.
T3: قطر تومور از پنج سانتی متر بيشتر است.
T4: فارغ از اندازه ، تومور خود را به ديواره سينه چسبانده و به غده لنفاوی سينه دست اندازی كرده است.
N نشان دهنده درگيری غده های لنفاوی است.
NX: غده های لنفاوی قابل تشخيص نيستند.
N0: سرطان به غده های لنفاوی دست اندازی نكرده است.
N1: سرطان به غده های لنفاوی قابل حركت زير بغل همان سمت پستان درگير دست اندازی كرده است.
N2: سرطان به غده های لنفاوی زير بغل دست اندازی كرده است.
N3: سرطان به غده های لنفاوی پستانی و Supraclavicular دست اندازی كرده است.
M نشانه متاستاز است.
MX: متاستاز قابل تشخيص نيست.
M0: متاستازی به ساير اندامها مشاهده نمی شود.
M1: متاستاز به ساير اندامها صورت گرفته است.
ماموگرافی اپتيک Comfort Scan
مـامـوگرافی اپتيک: تكنيكی جديد جهت نشان دادن ضايعات پستان در زنانی كه يافتههای تصويری مبنی بر حضور ضايعات درجه 4 تا 5 (BIRADS (Breast Imaging Reporting and Data System غير قابل لمس دارند.
هدف اين روش آينده نگر اين است كه كارآمدی تشخيص تصوير برداری به روش جـذب نـور نـزديـک بـه مـادون قـرمز در پستان را در بيماران دارای سيستم اطلاعات و گزارشهای تصويربرداری پستان BIRADS مبنی بر درجه 4 تا 5 ضايعات غير قابل لمس بر اساس بيوپسی كه به وسيله روشهای پاتولوژی بعد از بيوپسی هسته ای يا بيوپسی اكسزيونال به عنوان مرجع به دست آمده است بررسی كند.
پستان بيمار در وضعيتی خاص در صفحه ای از ديودهای متصاعد كننده نور قرمز قرار میگيرد.
نور عبور داده شده به وسيله يک دوربين CCD دريـــافـــت مـــیشـــود. كـــل دوره 1 دقـيـقـــه طـــول میكشد. پروسه تصويری ، تصاويری ديناميک تهيه میكند كه در مدلی رنگی نشان داده میشود تا تغييرات ناشی از گذران زمان در شدت نور گـذر داده شـده را (كـه بـه وسيله تغييرات فشار ايــجـــاد شــده انــد) اصــلاح كـنــد. مـنـحـنــیهــای ديـنـامـيـک در دو گـروه طـبـقـه بـنـدی مـیشـوند: شدتهای ثابت كاهش يابنده كه مشكوک به بــدخـيـمــی انــد و شــدتهــای افــزايــش يــابـنـده سينوسی كه به عنوان موارد خوش خيم شناخته میشوند. تصويربرداری نوری ديناميک پستان روشی جديد ، كم هزينه و غيرتهاجمی است كه نوع جديدی از اطلاعات را درباره فيزيولوژی ضايعات پستان ارائه میدهد. جذب حاصله در نـتـيـجــه هـمــوگلـوبيـن و محصـولات آن اسـت ، بـنـابـرايـن نـتـيـجـه وضـعـيـت عـروقـی تومورهای پستان را نشان میدهد.
سـرطـان پـسـتـان ، بـعد از سرطان ريه دومين علت مرگ و مير به دليل سرطان در زنان است. مــامــوگـرافـی روش تـصـويـربـرداری اسـتـانـدارد جهانی جهت مشخص كردن و تشخيص دادن تـــومــورهــای پـسـتــان اســت. ســايــر روشهــای تصويربرداری مورد استفاده در كنار ماموگرافی و معاينه بالينی ، به طور عمده سونوگرافی و MRI هستند. «سی تی اسكن» و «سنتی ماموگرافی به وسيله ماده حاجب سستاميبی» در بعضی موارد خاص مورد استفاده قرار گرفته اند ، اما به طور معمول انجام نمی گيرند.
يک سيستم تصويربرداری به كمک نور كه تغييرات بسيار جزئی فيزيولوژيک در بافت را تشخيص دهد ، میتواند امكانات قراردادی ارزشمندی را به تصوير برداری پستان بيافزايد. به طور كلی ، تصويربرداری اپتيک میتواند فعاليت بافتی را به وسيله ضـربانات نور مادون قرمز با چگالی پايين ، در بافت مورد تصويربرداری نشان دهد. مجموعه ای از گيرندهها مقدار نور رسيده به خودشان و زمان گذر اين نور از بافت را ثبت میكنند. اين اندازه گيریها ، وسعت اين مسئله كه كدام نور پراكنده شده و كدام نور جذب شده را مشخص می كند. اين تصاوير به علت تغييرات رخ داده به علت حضور خون اكسيژنه يا بدون اكسيژن ، اتفاق میافتند.
اطـلاعات جمع آوری شده را میتوان جهت نشان دادن ميزان اكسيژن رسانی و جريان خون منطقه مورد مطالعه ، استفاده كرد. اطلاعات فيزيولوژيک مستقيماً وابسته به ميزان رگ دار بودن تومور و نيز مقادير اكسيژن آن است و همه اينها به روشی كم هزينه ، غير يونيزه و غيرتهاجمی به دست آمده است. تظاهرات اصلی اين روش ، اطلاعاتی فضايی - محدود به علت انتشار ذرات نور هستند كه تصاويری دارای وضوح بالا از عروق خونی پستان به دست میدهند و طيفی از اطلاعات را فراهم میكند كه اجازه اندازه گيری عملی اكسيژن رسانی ، غلظت هموگلوبين و محتوای آبی و چربی بافت را مقدور می سازند. بدخيمیها به طور عمده دارای حجم بيشتر خون هستند در حالی كه بافتهای خوش خيم خون كمتر و نيز خون اكسيژنه كمتری دارند.
هردو اين نشانهها را میتوان با روش تصويربرداری اپتيک مشخص نمود. وقتی يک طول موج منفرد مورد استفاده قرار میگيرد ، مقدار جذب نوری كه نشان دهنده ميزان رگ دار بودن تومور است میتوان ارزيابی كرد. بنابراين ، اين تكنيک می تواند اطلاعات اضافی درباره تشخيص و مشخص كردن ضايعات پستان از طريق افزايش ميزان عروق، فراهم آورد. نواحی بافتی هيپوكسيک ، قوياً نشان دهنده حضور يک بدخيمی زمينه ای هستند.
MRI پستان همين اطلاعات را فراهم میآورد اما هزينه بسيار بيشتری دارد. اين روش قطعـی در بسيـاری از مطـالعـات استفـاده شـده اسـت. تصـويـربرداری اپتيک به وسيله مـامـوگـرافـی و يـافتـههـای سـونـوگرافی اصلاح شده است و تأييد به وسيله پاتولوژی نيز انجام گرفته است. با اين حال ، اين مطالعات به طور خاص بر روی مطالعه ضايعات غير قابل لمس پستـان بـه وسيلـه تصـويـربـرداری اپتيـک تمـركز نداشته اند.
در مـــيــــــان انــــــواع مـــخـــتـــلــــــف روشهــــــای تصـويـربـرداری اپتيـک پستـان كـه امروزه تحت مطـالعـه هستند ، تصويربرداری اپتيک ديناميک پستان ، روشی نوآورانه برای مشخص ساختن و تشخيص عروق در ضايعات پستان است.
نوری نزديک به نور مادون قرمز محدوده 640 نـانـومتـر بـه وسيلـه ديـودهـای متـوسط 127 نور (LED) منتشر شده و در بافت پستان نفوذ كرده و پـخــش مــیشــود. تـنظيـم LED جهـت بـه دسـت آوردن بيشترين ميزان شدت نور در منطقه مورد نـظـر ، بـر اسـاس مـحـل ضـايـعـه طـبـق يـافـتـههای ماموگرافی يا سونوگرافی صورت می گيرد. يک فلش از محل نوک سينه تا منطقه مورد نظر كشيده مـیشـود تـا مـحـل ضـايـعـه مـشخص شود. تمام تـنـظـيـمـات بـر اساس بهترين انتشار نور مادون قـرمز و بهترين ميزان جذب صورت میگيرد. يک سيستم دوربينی سيگنالهای متصاعد شده از سـطـح پـسـتـان را دريـافـت مـیكـنـد تا تصوير ديجيتال پستان را در زمان پروسه تصويربرداری تشكيل دهد (اندازه هر پيكسل 4763/0 ميليمتر) چندين تصوير در هر ثانيه به وسيله دوربين CCD بــرای حـدود 45 ثـانـيـه ثـبـت مـیشـود و جـهـت درمانهای تصويربرداری بعدی استفاده شود. زمان كل پروسه صورت گرفته 70 ثانيه است.
در پايان انجام اسكن ديناميک نوری ، سه نوع مختلـف از تصـويـر در صفحـه مـانيتـور دستگـاه نشان داده میشود.
بـيـولـوژی مـولكولی شامل فاكتورهای رشد عروقی است كه مسئول تكامل استرومای غير طـبـيعی عروق تومور میشوند. تشكيل عروق جـديـد ، يـكـی از نشانههای فعال بودن مولكول است و به دقت نمايانگر مرحله مولكولی حاضر و توانايی تهاجمی بودن ضايعات بدخيم است. تـصـويـربرداری از تشكيل عروق جديد اصولا نيازمند پروسههای راديولوژيک تهاجمی مثل آرتـريـوگـرافـی پـركـوتـانـه پـس از كـاتتريزاسيون عروق محيطی يا آنژيوگرافی به وسيله سی تی اسكن و MRI پس از تزريق داخل وريدی يک ماده حاجب مناسب است.
به علاوه در تمام مواردی كه يک ماده حاجب استفاده میشود ، بايد يک رگ مناسب محيطی را تعبيه نمود كه جدا از آزاردهنده بودن موضوع ، هزينههای اين روشها و نيز موارد ممنوعيت خاص مانند آلرژی يا ترس از اين روشها ، منجر به انجام اين پروسهها به گونه ای غير ايده آل شده است.
اخيـراً مـامـوگـرافـی بـه روش نـوری بـه عنـوان يـک روش بـالقـوه و نـوآورانه جهت تصويربرداری و هدف قرار دادن و تشخيص و در صورت امكان مشخص كردن نوع استرومای عروقی بافتهای طبيعی و غير طبيعی به كار گرفته شده است. در موجود زنده (invivo) و در آزمايشگاه (ex vivo). مطالعات بی شماری صورت گرفته اند تا اعتبار و سهولت اين روش را بررسی و حساسيت آن را ارزيابی كنند. در موجودات زنده ، روش تصويربرداری نوری به ميزان گسترده ای در ضايعات بافت پستان به كار گرفته شده است. علت اصلی اين امر ، حجم كوچک پستان و سطحی بودن نسبی ضايعات در مقايسه با ساير ارگانهای عميق داخل شكم است. زيرا نور هرگز نمی تواند به راحتی به هدفهای عمقی نفوذ كند و هموگلوبين شدت كافی را حفظ كند. ماموگرافی اپتيک تقريباً به ميزان گسترده ای از تشعشع نور مادون قرمز (طيف 640 تا 800 نانومتر) استفاده میكند. عروق خونی و نواحی غني از رگ ، تصاوير دارای كنتراست نوری بالا ايجاد میكنند كه علت اين مسئله جذب افزايش نور مادون قرمز است و لذا در نهايت شكل فضايی منحصری ايجاد میكنند. الگوريتمهای مختلف آناليز كمی تصاوير اخذ شده را مقـدور كـرده انـد (چـه استـاتيـک و چـه ديناميک) كه پايه اصلی اينها تخمين غلظت هموگلوبين و اكسيژن دار بودن است كه يک سری اطلاعات رنگی را میدهد.
امروزه تحقيقات نقش مطمئن ماموگرافی را ثابت كرده اند كه به تنهايی يا در تركيب با امكانات تصويربرداری تهاجمی يا غير تهاجمی مانند سونوگرافی يا MRI به كار گرفته شده است. اگر چه مطالعات زيادی كه بر اساس تصويربرداری نوری مادون قرمز پستان در بيماران دارای ضايعات پستان با درجه 4 و 5 BIRADS باشد وجود ندارد. اين نتايج منعكس كننده انجام تصاوير نوری بر اساس سه مرحله متفـاوت از آنـژيوژنز تومور بود. تشخيص كار سينوم داخل مجرايی بسيار سخت بود كه علت آن فاكتورهای متعددی است با ضايعه بدخيم كه به غشای پايه محدود باشد. ممكن است به طور اوليه ساختار فيزيكی را تحت تأثير قرار ندهد ، در حالی كه ضايعات مهاجم تر اين كار را میكنند. عـامـل ديگـر احتمـالا اين است كه آنژيوژنز در مـراحـل ابتـدايـی كـارسينـوم داكتال در جا يعنی زمـانـی كـه تـومـور محـدود بـه مجرا است كمتر پيشرفت كرده است.
نتايج اوليه تحقيقات نشان دهنده اين مسئله است كه ماموگرافی اپتيک ديناميک يک روش نوآورانه ، ساده ، قابل تحمل و عاری از يونيزه كردن بافت است كه میتواند در كشف نواحی پستان هيپرمتابوليک و هيپوكسيک كه مشكوک به بدخيمی (تودههای غير قابل لمس در موارد 4 DCIS و 5) هستند مورد توجه قرار گيرند. با اين حــال ، بـهـبــود بـخـشـيــدن تـكـنـيــک در آيـنـده و مطالعات بيشتر مورد نياز است تا هر گونه كاربرد بالينی محتمل را شرح دهند.
منبع: ماهنامه مهندسی پزشکی